编者按:非洲猪瘟病毒的理化特性和对不同环境的耐受性已有大量研究论文和总结详尽的综述,但是非洲猪瘟病毒在饲料和饲料原料中的稳定性鲜有报道,是非瘟研究的一个空白,而饲料是与猪接触最直接和广泛的一种潜在传播媒介,饲料污染问题深受从业者关心,本期选择一篇尚在同行评议阶段的文章,对这一问题提供部分答案,以期为大家带来最新的非瘟知识。

摘要
非洲猪瘟(ASF)是一种感染猪科成员的病毒性疾病,被世界动物卫生组织(OIE)列为法定报告动物疫病,对全球养猪业、动物健康和食品安全造成重大威胁。根据欧洲食品安全局(European Food Safety Authority)的综述,ASF病毒(ASFV)在饲料和饲料原料中的存活和传播是一个主要的研究空白。在此背景下,本研究的目的是确定ASFV在两种不同储存温度下的再污染喷雾干燥猪血浆(SDPP)中的存活率。因此,我们人为模拟最糟糕的污染情况,用高滴度ASFV污染商品化的SDPP颗粒。每个时间点和温度条件下取3个样本在巨噬细胞上盲传,随后进行红细胞凝集试验,以确定残留病毒传染性。此外,采用实时PCR检测病毒基因组。
结果表明,严重污染的SDPP在4℃保存下,传染性至少持续5周。而在室温保存下,ASFV滴度1周后明显下降,2周后完全失活。综上所述,如果在饲养前将污染的SDPP在室温下保存至少2周,则ASFV通过污染SDPP传播的风险较低。
引言
非洲猪瘟(ASF)是全球养猪业、动物健康和食品安全的主要威胁。致病因子ASF病毒(ASFV)是一种具有高韧性的复杂、有囊膜的DNA病毒,属于非洲猪瘟病毒科。考虑到ASFV在多种环境条件下的稳定性,养殖户和其他利益相关者很关注ASFV通过饲料和饲料成分的传播情况,但遗憾的是,此类基础数据非常有限。
在此背景下,欧洲食品安全局 (EFSA) 也明确了关于ASFV通过受污染饲料和饲料原料传播的可能性的研究缺口。特别值得注意的是猪源饲料原料,如喷雾干燥猪血浆(SDPP)。SDPP广泛应用于猪的教槽料中,可持续提高生长性能和存活率,特别是在病原体入侵等应激条件下。
目前,关于再污染猪血浆中ASFV灭活的研究还很少。Kalmar等人在2018年研发了一种物理和化学处理条件组合的猪血浆加工工艺,即热处理(48°C)、碱性条件(pH=10.2)和添加过氧化物(102.9 mM H2O2)。该处理可在10分钟内使ASFV滴度降低4.17log10 TCID50/ml。Polo等人(2019)报道,用3000 J/l剂量的C类紫外光(UV-C)照射液态猪血浆后,病毒滴度可降低4.62log10 TCID50/ml。喷雾干燥过程本身的入口温度为200℃,流通过程的整个物质温度为80℃,导致ASFV滴度降低4.11log10 TCID50/ml。上述研究主要涉及原材料的初始污染,即来自ASFV感染猪的血浆。但是,也有人对可能出现的再污染情况表示担忧。
因此,本研究的目的是确定ASFV在生产后再次污染的SDPP不同温度(4℃和室温)下储存不同时间(0、7、14、21、28和35天)的稳定性。为此,用高滴度ASFV (106 半数血球吸收剂量/ml [HAD50/ml]) 污染商品化SDPP颗粒,通过实时PCR证实污染成功。在每个时间点和温度条件下,取3个样本在外周血单核细胞(PBMC)衍生的巨噬细胞上盲传,随后进行血液吸附试验(HAT),以确定残留传染性。
材料与方法
样品制备
本研究使用的喷雾干燥猪血浆(SDPP)来自商业生产商(APC, Villarrobledo,西班牙)。70克SDPP(最大湿度9.0%)被10.5 ml 106HAD50/ml滴度的ASFV(“亚美尼亚08”毒株)混悬液污染。污染过程在一个拉链袋中进行,病毒悬浊液使用鼻内粘膜雾化装置(MAD Nasal;伍尔夫托里医疗,盐湖城,美国)雾化后分两步加入(5 ml + 5.5 ml),两步之间干燥15分钟。在室温下额外干燥和摇晃15分钟后,污染的SDPP以2 g等量分配于50 ml试管中(Sarstedt, Nümbrecht,德国),在4℃或室温下保存。分别在第0、7、14、21、28、35天取3份SDPP样品-80℃保存,以待进一步分析。3份未污染的SDPP样品作为阴性对照(NC)立即与一份原病毒悬液(VS T0)一起保存在-80℃。另外,将900µl的病毒悬液在4℃或室温下孵育7天或35天,然后在-80℃保存。
分析之前,-80°C保存的SDPP样品用10 ml含1%抗生素-抗霉剂混合物(Gibco抗生素-抗菌剂100×; Thermo Fisher Scientific,施韦特,德国)的无菌蒸馏水涡旋震荡重悬。2毫升复原血浆保存在-80°C进行实时PCR分析,以证明成功污染。剩余血浆作为接种物接种外周血单核细胞(PBMC)来源巨噬细胞盲传,以确定是否能检测到残余的传染性ASFV。
巨噬细胞的分离,盲传和血球吸附实验
PBMC来源的巨噬细胞分离自健康家猪的EDTA-抗凝血。将密度为1×107细胞/ml的 PBMCs接种到6孔组织培养板(Primeria; Corning, 达拉谟,美国),用含10%胎牛血清(FCS)和1%抗生素-抗霉素混合物(Thermo Fisher Scientific,施韦特,德国)的IMEM-F12混合培养基(Thermo Fisher Scientific,施韦特,德国)在37°C、5% CO2条件下培养24小时,更换培养基以去除没有贴壁的细胞,用1ml磷酸盐缓冲液(PBS)冲洗贴壁巨噬细胞,随后补充含有2ng /ml GM-CSF(粒细胞-巨噬细胞集落刺激因子;Biomol,汉堡,德国)的培养基以促进巨噬细胞成熟。孵育24小时后,进行盲传,吸去培养基,加入1ml复原血浆(接种物),37℃孵育2h,吸弃接种物, 1ml PBS冲洗培养物,然后加入不含GM-CSF的新鲜培养基。平板孵育72 h,-80℃保存,以待HAT和实时荧光定量PCR分析。
为了证明病毒传染性,将PBMCs接种到96孔板(Primeria; Corning, 达拉谟,美国),密度为5 × 106细胞/ml(每孔100µl),按照上述方法培养。随后,取每个盲传样品100µl,分别接种96孔板的四孔(四倍值)。此外,准备病毒悬液样品进行终点滴定。为此,将样品10倍倍比稀释,每个稀释倍数接种4孔。37℃孵育24 h后,每孔加入20µl 1%同源红细胞悬液。之后4天,观察分析血细胞吸附反应(形成玫瑰花环),读取结果。在第二轮HAT试验中,病毒阳性盲传样品和病毒悬液样品被滴定,以获得生物学重复的终点滴度。由于病毒稀释和重复孔的数量,检测限为1.75 log10半数血球吸附剂量/ml (HAD50/ml)。采用Reed和Muench法计算滴度,以log10HAD50/ml表示。作图和计算分别使用GraphPad Prism 8 (GraphPad Software Inc, 圣地亚哥,USA)和Excel 2013版 (Microsoft GmbH, Unterschleißheim, Germany)。
核酸提取和实时荧光定量PCR
在进行实时PCR分析之前,根据制造商的建议,使用试剂盒NucleoMag VET(Machery-Nagel, Düren, 德国)在自动核酸提取平台KingFisher 96 flex(Thermo Fisher Scientific,施韦特,德国)上提取所有样本(接种物、盲传培养物、病毒悬液)的病毒核酸。随后,在荧光定量仪Bio-Rad CFX real-time cycler (Bio-Rad Laboratories, Hercules, 美国)上,采用King等人2003年发表的实时PCR 方法,结合基于EGFP检测系统的内部控制,对核酸进行分析。
对于每个实时 PCR,定量周期(Cq)值是根据反应产物荧光信号在统计学上超过Biorad CFX软件设定的背景值时的PCR循环数确定的。利用倍比稀释的ASFV保守基因 DNA标准品,制作绝对荧光定量标准曲线,测定各样本中的基因组拷贝数。为了制备ASFV标准品,根据制造商的建议,使用QIAamp公司的病毒RNA提取试剂盒QIAamp Viral RNA Mini Kit (Qiagen, Hilden, 德国)从ASFV“亚美尼亚08”株感染PBMC培养上清中提取DNA。随后,使用Nanodrop 2000c(Thermo Fisher Scientific,施韦特,德国)分光光度法测定DNA浓度,并使用在线工具(http://www.molbiol.edu.ru/eng/scripts/01 07.html)计算出准确的DNA分子数量。
结果与讨论
病毒悬液、污染SDPP和盲传培养物实时PCR分析
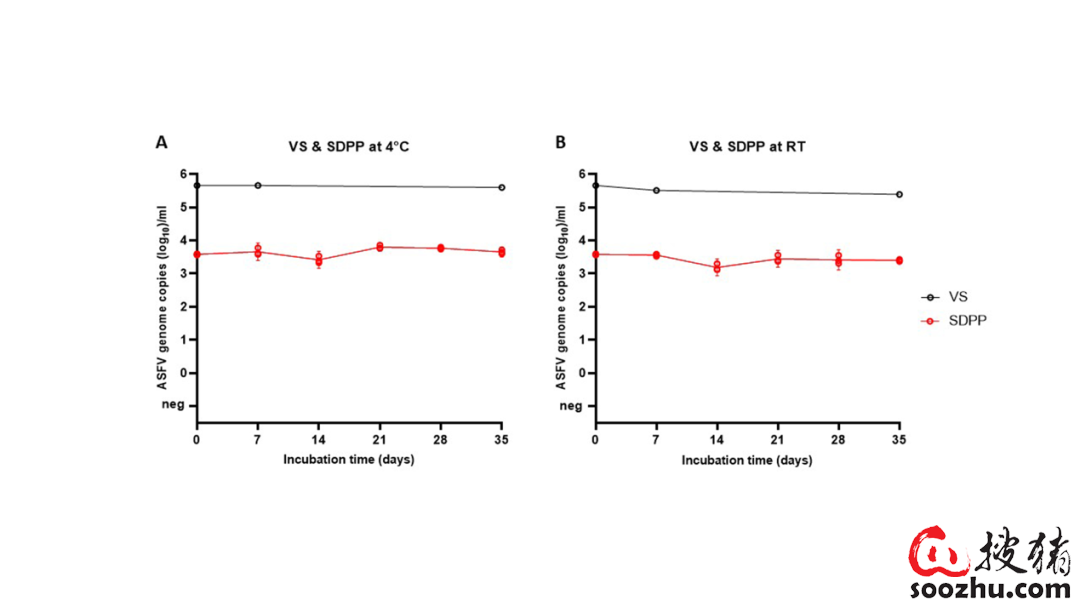
用于污染SDPP的病毒悬液含有高基因组拷贝数(5.66 log10/ml,图1)。作为对照,原始的病毒悬浊液在与SDPP样品相同的条件下保存35天。无论储存温度(分别为4℃或室温)如何,在病毒悬液中,ASFV基因组拷贝数在整个观察期间都是恒定的(拷贝数在5.66至5.39 log10/ml之间)。然而,拷贝数并不能得出任何关于传染性病毒粒子数量的结论。
相比之下,作为盲传接种物的污染SDPP,由于分散在SDPP上,其基因组拷贝数低于初始病毒悬液。这种扩散效应也可以在农作物污染中看到。在所有样本中均可检测到ASFV的全部基因组,表明SDPP被成功污染(图1)。此外,无论储存温度高低,SDPP的基因组拷贝数并没有随着时间的推移出现任何明显的下降。未处理的血浆阴性对照(NC)中未检测到ASFV基因组。
4℃保存的污染SDPP盲传后的PCR分析显示,在整个观察期间,这些标本都表现ASFV基因组强阳性(拷贝数在7.32-6.52 log10/ml之间,图2A)。这些值超过了初始病毒悬液的病毒载量,表明在盲传期间ASFV在巨噬细胞中的有大量的扩增。相比之下,室温保存下,只有一个在保存1周的SDPP盲传重复中显示PCR阳性(4.88 log10 基因组拷贝/ml,图2A)。
病毒悬液和盲传培养物终点滴度
一般来说,病毒悬液的终点滴度在4°C保存5周内保持稳定。在室温下,随着时间的推移,病毒滴度从6.0下降到4.13 log10HAD50/ml。Dee等人2018年还观察到,在模拟跨大西洋运输条件的30天存储期间,病毒滴度也出现了类似的下降(从5.0 log10 TCID50下降到3.0 log10 TCID50)。总的来说,在整个观察期间,不论储存温度如何,病毒悬液仍具有传染性。
对于保存在4℃下的被污染的SDPP盲传样品,病毒滴度在整个研究期间保持不变(7.75 - 6.50 log10 HAD50/ml,图2B)。因此,污染的SDPP在4℃保存至少5周仍具有传染性。相比之下,在室温下保存的受污染的SDPP盲传样品只显示出部分ASFV传染性(三分之一的重复HAT阳性),且1周后滴度明显下降(图2B)。2周后,观察到ASFV完全失活。这一发现与相应的real-time PCR结果一致(图2A)。与猪流行性腹泻病毒(PEDV)相比,PEDV在喷雾干燥牛血浆中4℃下3周后完全灭活,或在室温下1周后完全灭活, ASFV在SDPP上表现出更高的稳定性。
在判断这些结果时,需要考虑HAT检测系统的灵敏度。与生物测定法(即猪接种法)相比,HAT的敏感性较低。然而,在这种情况下,这种敏感性的差异不应引起关注,因为Blázquez等2020年证明,在混合了ASFV污染的液态猪血浆的饲料中,最低感染剂量高于5.0 log10TCID50/头猪(每头猪半数组织培养感染剂量)。
SDPP是ASFV传播的危险因素
已经表明,喷雾干燥过程本身对各种影响猪的病毒有灭活效果,例如猪水泡病 (SVDV),伪狂犬病病毒(PRV),猪繁殖与呼吸综合征病毒(PRRSV)或ASFV。因此,我们研究了SDPP加工后的再污染,以及生产过程中初始滴度降低后残留的ASFV传染性的可能性。因此,本研究为评估ASFV通过受污染的SDPP传播的风险提供了有价值的数据。根据所得到的结果,我们得出结论,在室温下储存至少14天,可以降低按照欧洲标准生产的SDPP再污染的剩余风险。
附图解释
图1:在4℃(A)和室温(B)下病毒悬液(VS)和接种物(SDPP) 随时间的拷贝数。空心圆代表单个重复的值,实线和误差棒代表平均值和标准差。Neg:阴性结果
图2: 盲传后病毒载量:拷贝数(A)和病毒滴度(B)。空心圆代表单个重复的值,实线和误差棒代表平均值和标准差。Neg:阴性结果
(审核编辑: 猪猪侠)





















